Contoh Soal Mol – Ketika kamu sudah mulai masuk pada materi Mol, Molalitas, Molaritas sampai dengan Normalitas dalam sebuah materi penghitungan jumlah larutan maka sudah barang pasti kamu juga harus tahu pengertianya, kemudian rumus sampai dengan belajar mengerjakan soal dari yang susah sampai dengan gampang.
Daftar Isi
Contoh Soal Mol, Molalitas, Molaritas dan Normalitas

Kesempatan ini kami akan mencoba mengupas itu semua dalam satu artikel lengkap sehingga pemhaman kalian dengan materi ini semakin lengkap dan mendalam.
Dalam ilmu kimia dasar termasuk ketika sudah masuk pada materi lauratan maka akan dikenal beberapa satuan populer dalam hal perhitunganya yakni mol, molalitas, molaritas, normalitas, ppm, persen massa, persen volum. Suapaya kamu lebih paham kita bahas saja langsung dibawah ini ya.
Mol Larutan (n)
Mol adalah massa (gram) suatu zat dibagi dengan massa molekul relatif/berat molekul suatu zat.
Rumus Mol
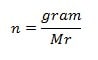
Keterangan:
n = mol suatu zat (mol)
gr = massa suatu zat (gr)
Mr = massa molekul relatif suatu zat (gram/mol)
Mol ekivalen adalah jumlah mol dikali dengan jumlah ion H+ atau ion OH-, Jika mol zat terlarut mengandung a ion H+ atau ion OH-, maka rumus mol ekivalen yaitu:
Mol ekivalen = n x a
Keterangan:
a = ekivalen suatu zat
n = mol suatu zat (mol)
untuk kimia asam, 1 mol ekivalen = 1 mol ion H+
untuk kimia basa, 1 mol ekivalen = 1 mol ion OH-
Contoh Soal Menghitung Mol (n)
1. Berapa jumlah mol dari 2 gram NaOH dengan Mr= 40 gr/mol?
Jawab:
n = gram/Mr
n = 2/40
= 0.05 mol
2. Berapa jumlah mol ekivalen dari 10 gram NaOH?
Jawab:
Mol ekivalen = n x a
Mol ekivalen = 10/40 x 1 = 0,25 mol ek
Molalitas Larutan (m)
Molalitas adalah jumlah mol zat terlarut dalam 1000 gram pelarut.
Rumus Molalitas
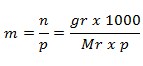
Keterangan:
m = molalitas suatu zat (molal)
n = mol suatu zat (mol)
p = massa pelarut (gr)
Contoh Soal Menghitung Molalitas
1. 60 gram NaOH dilarutkan dalam 3 kg air, Mr NaOH = 40 gr/mol. Berapa molalitas NaOH?
Diketahui:
n = 60 gram x 1000 = 60000 mol
p = 3 kg = 3000 gram
Mr = 40
Ditanya m…?
Jawab:
m = n/p
m = (gr x 1000)/(Mr x p)
m = (60 x 1000)/(40 x 3000)
m = 60000/120000
m = 0,5 molal
Molaritas Larutan (M)
Molaritas adalah jumlah mol zat terlarut dalam 1 liter larutan atau 1 mmol zat terlarut dalam 1 ml larutan. Satuan molaritas adalah mol/L.
Rumus Molaritas
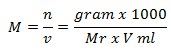
Keterangan:
M = molaritas suatu zat (mol/L)
gr = massa suatu zat (gram)
Mr = massa molekul relatif suatu zat (gr/mol)
V = volume larutan (ml)
Contoh Soal Menghitung Molaritas
1. NaOH 1 M berarti bahwa untuk setiap 1 liter (1000 ml) larutan ini mengandung 1 mol NaOH ((atau 40 gram NaOH).
2. 120 gram NaCl (Mr = 58.5gr/mol) dilarutkan dengan aquadest hingga volume 400 ml. Berapa M NaCl?
M = (gr x 1000) / (Mr x V)
M = (120 x 1000) / (58.5 x 400)
M = 5,1 mol/L
Normalitas Larutan (N)
Normalitas adalah jumlah mol ekivalen zat terlarut dalam 1 liter larutan. Satuan normalitas adalah mol ek/L.
Rumus Normalitas
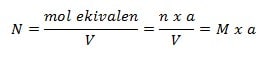
Keterangan:
N = normalitas ( mol ek/L)
n = mol suatu zat (mol)
a = ekivalen suatu zat
V = volume larutan (liter)
Contoh Soal Menghitung Normalitas
1. KOH sebanyak 112 gram dilarutkan dengan aquadest hingga volume 1000 ml (1 liter), Mr KOH = 56 gr/mol. Berapa normalitas KOH ?
N = (n x a) / V
N = (gr x a) / (Mr x V)
N = (112 x 1) / (56 x 1)
N = 2 mol ek/L
Part Per Million (ppm)
Part per million (ppm) atau bagian per juta (bpj) adalah satuan konsentrasi yang menyatakan perbandingan bagian dalam 1 juta bagian yang lain. ppm dinyatakan dengan satuan mg/kg atau mg/L.
Contoh ppm
Suatu air minum mengandung besi sebesar 2 ppm artinya bahwa setiap 1 liter air minum tersebut (massa jenis air = 1) mengandung 2 mg besi.
Persen Massa
Simbol satuan persen massa adalah % (b/b).Rumus persen massa yaitu:

Contoh Soal Menghitung Persen Massa
1. NaOH 60% (massa) diartikan bahwa dalam setiap 100 gram larutan ini mengandung 60 gram NaOH.
2. 20 ml H2SO4 95% (massa jenis = 1.834) terlarut dalam 100 ml air (massa jenis air = 1), maka besar konsentrasi larutan asam sulfat dalam % ?
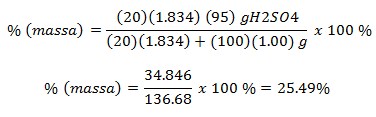
Persen Volum
Simbol satuan persen volum adalah % (v/v). Rumus persen volum yaitu:

Contoh Soal Menghitung Persen Volum
1. Alkohol 65% (volum) diartikan bahwa dalam setiap 100 ml larutan ini mengandung 65% alkohol dan 35% air.
2. 25 ml alkohol 96% dicampur dengan air 75 ml, maka konsentrasi larutan alkohol?
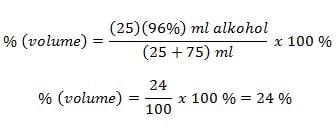
Demikian pembahasan tentang “Pengertian, Rumus dan Contoh Soal Mol, Molalitas, Molaritas dan Normalitas Larutan Lengkap” , semoga bermanfaat.
Pengertian, Rumus dan Contoh Soal Molalitas dan Fraksi Mol Lengkap
Molalitas atau kosentrasi molal adalah ukuran konsentrasi dari suatu zat terlarut di dalam suatu larutan dalam hal jumlah zat dalam sejumlah massa tertentu dari pelarut.
Hal tersebut berbeda dengan definisi molaritas yang berdasarkan pada volume tertentu larutan. Satuan umum molalitas dalam kimia yaitu mol/kg. Suatu larutan dengan konsentrasi 1 mol/kg juga terkadang dinyatakan sebagai 1 molal.
Istilah molalitas ini dibentuk dalam analogi terhadap molaritas yang merupakan konsentrasi molar dari suatu larutan. Molalitas suatu larutan bisa diuji dengan menambahkan beberapa zat pelarut. Lebih sederhananya, Molalitas (m) larutan adalah mol zat terlarut dibagi dengan kilogram pelarut. Kemolalan atau molalitas adalah konsentrasi larutan yang menyatakan jumlah mol (n) zat terlarut dalam 1 kg atau 1000 gram pelarut.
Perbedaan molalitas dan molaritas yaitu jika molalitas adalah kemolalan atau konsentrasi molal (m) menyatakan banyaknya mol zat terlarut dalam 1000 gram pelarut sedangkan molaritas adalah pernyataan jumlah mol zat terlarut dalam setiap satu liter larutan. Molaritas dilambangkan dengan notasi M dan satuannya adalah mol/liter.
Rumus Molalitas
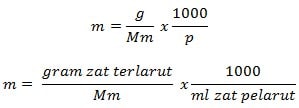
Keterangan
m = molalitas (mol/kg)
g = gram zat terlarut (g)
Mm = massa molar zat (g/mol)
P = massa zat pelarut (g)
Hubungan Molalitas dengan Persen massa
Persen massa adalah satuan konsentrasi yang biasa digunakan dalam larutan kimia. Contohnya larutan yang bisa kita temukan sehari-hari yaitu larutan alkohol 75% dan larutan asam cuka 24%. Persen massa adalah jumlah gram zat terlarut dalam 100 gram massa larutan. Persamaan yang menunjukkan perhitungan persen massa adalah sebagai berikut :
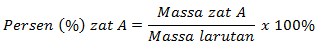
Hubungan Molalitas dengan Molaritas
Molaritas menyatakan jumlah mol zat terlarut dalam satu liter larutan. Molaritas dapat dikonversikan menjadi molalitas dengan merubah volume larutan menjadi massa larutan. Pengubahan volume menjadi massa membutuhkan data massa jenis larutan (p), yang dapat dirumuskan sebagai berikut:
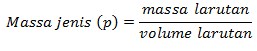
Fraksi Mol
Fraksi mol adalah suatu ukuran konsentrasi larutan yang menyatakan perbandingan dari jumlah mol pada sebagian zat terhadap jumlah keseluruhan mol yang ada dalam komponen larutan. Fraksi mol dibagi menjadi 2 bagian yaitu:
Fraksi mol zat terlarut (Xt)
Rumus fraksi mol zat terlarut (Xt), yaitu:
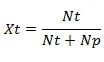
Keterangan:
Xt = fraksi mol zat terlarut
Nt = jumlah mol zat terlarut
Np = jumlah mol zat pelarut
Fraksi mol zat pelarut (Xp)
Rumus fraksi mol zat pelarut (Xp), yaitu:
![]()
Keterangan
Xp = fraksi mol zat pelarut
Nt = jumlah mol zat terlarut
Np = jumlah mol zat pelarut
Jumlah fraksi mol zat terlarut dan zat pelarut adalah 1
Xt + Xp = 1
Contoh Soal Molalitas dan Penyelesainya
1. Berapakah molalitas larutan yang mengandung 8 gram NaOH (Ar Na = 23 gr/mol, Ar O = 16 g/mol, dan Ar H = 1 gr/mol) terlarut dalam 250 gr air?
Pembahasan
Diketahui:
Massa NaOH = 8 gr
Ar Na = 23 gr/mol
Ar O = 16 g/mol
Ar H = 1 gr/mol
massa air = 250 gr = 0,25 kg
Ditanya: Molalitas (m)….?
Jawab:
Mr.NaOH = 40 gr/mol
Jumlah mol NaOH = massa/Mr
Jumlah mol NaOH = 8 gr/(40 gr/mol)
Jumlah mol NaOH = 0,2 mol
m = jumlah mol/p
m = 0,2 mol /0,25 kg
m = 0,8 m
2. Tentukan molalitas larutan yang dibuat dengan melarutkan 15 gram urea CO(NH2)2 dalam 250 gram air.
Pembahasan
Diketahui:
Massa urea = 15 gr
Mr Urea= 60 g/mol
Massa pelarut = 250 gr = 0,25 kg
Ditanya: Molalitas (m)…. ?
Jawab:
Jumlah mol Urea = massa/Mr
Jumlah mol Urea = 15 gr / 60 g/mol
Jumlah mol Urea = 0,25 mol
m = jumlah mol/ massa pelarut
m = 0,25 mol /0,25 kg
m = 1 m
3. Berapakah molalitas dari larutan HCl 37% (w/w)? (Ar H = 1 g/mol, Ar Cl = 35,5 g/mol).
Pembahasan
Diketahui:
massa HCl = 37%
Ar H = 1 g/mol
Ar Cl = 35,5 g/mol
Ditanya: Molalitas (m)…?
Jawab:
Mr.HCl = 36,5 gr/mol
Misalkan massa larutan adalah 100 gr maka massa HCl yaitu:
massa HCl = 37% x 100 gr
massa HCl = 37 gr
massa pelarut = massa larutan – massa HCl
massa pelarut = 100 gr – 37 gr
massa pelarut = 63 gr = 0,063 kg
jumlah mol HCl = massa/Mr
jumlah mol HCl = 37 gr /(36,5 gr/mol)
jumlah mol HCl = 1,01 mol
m = jumlah mol/ massa pelarut
m = 1,01 mol /0,063 kg
m = 16,03 m
4. Tentukan banyaknya (gram) NaOH yang harus dilarutkan dalam 1 liter air (air = 1,00 g/mL) agar diperoleh NaOH 0,25 m.
Pembahasan
Diketahui:
1 L air = 1.000 mL = 1.000 g (karena ρ air = 1,00 g/mL)
m NaOH = 0,25 m
Mr NaOh = 40
Ditanya: gr…?
Jawab:
m NaOH = gr / Mr x 1.000 / P
0,25 = gr/40 x 1.000/1.000
0,25 = g/40
g = 0,25 x 40
g = 10 gram
Jadi, banyaknya NaOH yang diperlukan adalah 10 gram.
5. Tentukan berapa mL volume air yang diperlukan untuk melarutkan 4,9 gram H2SO4 yang konsentrasinya 0,25 M (Ar H = 1; S = 32; O =16)!
Pembahasan
Diketahui:
m H2SO4 = 0,25
Mr H2SO4 = 98
gr = 4,9 gram
Ditanya: p..?
Jawab:
m = gr/Mr x 1.000/P
0,25 = 4,9/98 x 1.000/p
p = 20 gram (20 mL)
Jadi, volume air yaitu sebesar 20 mL.
Cara Menghitung Kemolaran, Kemolalan dan Kenormalan Larutan
Molaritas adalah jumlah mol zat terlarut dalam 1 liter larutan atau 1 mmol zat terlarut dalam 1 ml larutan. Satuan molaritas adalah mol/L. Molalitas adalah jumlah mol zat terlarut dalam 1000 gram pelarut. Normalitas adalah jumlah mol ekivalen zat terlarut dalam 1 liter larutan. Satuan normalitas adalah mol ek/L. Dalam kimia, satuan-satuan tersebut sering digunakan untuk menyatakan konsentrasi larutan atau banyaknya zat terlarut dalam jumlah pelarut.
Berbicara tentang molaritas, molalitas dan normalitas, kali ini kita akan membahas tentang kemolaran, kemolalan dan kenormalan larutan.
Pengertian Kemolaran
Kemolaran adalah banyaknya mol zat terlarut dalam tiap liter larutan dan dinotasikan dengan huruf M. Harga kemolaran bisa ditentukan dengan menghitung mol zat terlarut dengan volume larutan. Volume larutan adalah volume zat terlarut dan pelarut setelah bercampur.Satuan ini banyak digunakan dalam stoikiometri untuk menghitung zat terlarut.
Contoh Soal Menghitung Kemolaran Larutan
1. Hitung kemolaran glukosa, jika 17,1 gram sukrosa (C12H22O11) dilarutkan dalam air sehingga volume larutan mejadi 500 ml.
Pembahasan
Diketahui:
Massa sukrosa = 17,1
Mr C12H22O11= 342
volume = 500 ml = 0,5 l
Ditanya: Kemolaran (M)…?
Jawab:
n = gram/Mr
n = 17,1/342
n = 0,05 mol
Kemolaran (M) = n/v
M = n/v
M = 0,05/0,5
M = 0,1 M
2. Berapa jumlah mol soda kue (NaHCO3) yang diperlukan untuk membuat 150 ml larutan NaHCO3 0,35 M?
Pembahasan
Diketahui:
v = 150 ml
M = 0,35 M
Ditanya: n…?
Jawab:
Dalam NaHCO30,35 M berarti 1 liter larutan = -/+ 0,35 mol NaHCO3
n = v/1000 x M
n = 150/1000 x 0,35 mol
n = 0,0525 mol
Jadi jumlah mol NaHCO3 yang dibutuhkan untuk membuat 50 ml larutan NaHCO3 0,35 M yaitu 0,0525 mol.
Pengertian Kemolalan
Kemolalan adalah jum;ah mol zat terlarut dalam setiap 1000 gram pelarut murni. Nilai kemolalan dapat dihitung jika mol zat dan massa pelarut diketahui.
Contoh Soal Menghitung Kemolalan
1. Hitung kemolalan NaCl, jika garam NaCl sebanyak 5,85 gram dilarutkan dalam 500 gram air.
Pembahasan:
Diketahui:
Massa NaCl = 5,85 gram
Mr NaCl = 58,5
Ditanya: Kemolalan…?
Jawab:
n = gram/Mr
n = 5,58/58,5
n = 0,1 mol
Maka, diketahui nilai mol NaCl dalam 500 gram air yaitu sebesar 0,1 mol.
m NaCl = 1000/500 x 0,1 = 0,2 m
Kemolalan memuat informasi mengenai jumlah zat terlarut dan pelarut sehingga mudah digunakan untuk menghitung fraksi mol, jika kerapatan larutan diketahui. Nilai kemolalam bisa pula digunakan untuk menghitung nilai kemolaran.
Pengertian Kenormalan
Kenormalan adalah jumlah ekuivalen zatterlarut dalam tiap liter larutan. Ekuivalen zat dalam larutan bergantung pada jenis reaksi yang dialami zat tersebut, karena satuan ini digunakan untuk menyetarakan zat dalam reaksi.
Ekuivalen suatu zat terkait dengan molarnya dan hubungannya bergantung pada jenis reaksi, apakah reaksi asam basa atau redoks .
Dalam reaksi asam basa bergantung pada jumlah H+ dan OH- yang dilepaskan.
Contoh soal perhitungan kenormalan
HCl = H+ + Cl– 1 M HCl = 1 N
H2SO4 = 2H+ + SO4– 1 M H2SO4 = 2 N
NaOH = Na+ + OH– 1 M NaOH = 1 N
Ba(OH)2 = Ba+ + 2OH– 1 M Ba(OH) = 2 N
Pada reaksi redoks, nilai ekuivalen bergantung pada jumlah elektron yang terlibat yaitu dilepaskan atau diterima senyawa.
Fe + 2 HCl = FeCl2 + H2
Fe + 2H+ = Fe2+ + 8H+
Fe melepaskan dua elektron, maka 1 M Fe = 2 N
Hidrogen melepaskan satu elektron, maka 1 M HCl = 1 N
MnO4– + 5 Fe2+8H+ = Mn2+ + 5Fe3+ + 4H2O
Bilangan oksidasi Mn turun dari +7 menjadi +2 atau menerima 5 elektron dan bilangan oksidasi Fe naik dari +2 menjadi +3 atau melepas satu elektron. Maka kenormalannya yaitu:
1 M KmnO4 = 1 N
1 M FeCl2 = 1 N






